[Emilie Neveu] Vous avez choppé un virus ? Pour vous soigner, rien de tel qu’un peu de maths

Cela fait déjà plusieurs années que l’on peut plier soi-même ses protéines. Oui, oui, on peut plier des protéines.
Depuis 2008, Foldit, un jeu sérieux gratuit, mis en ligne par une équipe de recherche de l’Université de Washington, permet à tout un chacun de plier des protéines. En jouant à Foldit, tu peux aider à déterminer la forme en trois dimensions des protéines, tu peux concevoir de nouvelles protéines qui vont combattre les méchants virus, et tu peux même découvrir des stratégies de pliage encore plus efficaces que les plus efficaces stratégies calculées par les ordinateurs. Bref, tu peux sauver le monde.
Les protéines sont partout, dans toutes les cellules de notre corps. Nous avons des trillions de cellules dans notre corps, composant nos muscles, notre système immunitaire, notre sang… Dans chacune de ces cellules, on y trouve des protéines, « des ouvrières », qui assimilent la nourriture, communiquent des ordres aux muscles, et transportent les nutriments dans nos vaisseaux.
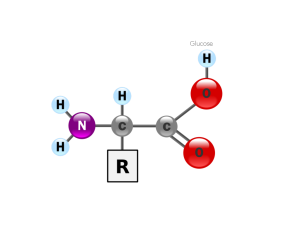
Il existe donc tout un tas de protéines différentes, mais leur particularité réside dans le fait qu’elles sont faites d’une chaine d’acides aminés qui sont de petites molécules composées de carbone, nitrogène, hydrogène, oxygène et plus rarement de sulfure. On trouve une vingtaine de ces petites molécules dans la nature, selon la composition de l’élément R, et c’est la combinaison de ces différentes molécules entre elles qui forment la variété des protéines et la variété de leurs fonctions.Si la composition des protéines en acides aminés est facilement déterminée en lisant le code génétique grâce aux nouvelles techniques de séquençage, il est beaucoup plus difficile de savoir comment la protéine se replie.
Le repliement tridimensionnel d’une protéine est un sujet de recherche passionnant. En effet, prenez ce virus de la grippe, H1N1.
Déjà, il est petit. Si petit qu’on ne peut le voir que difficilement, au travers de techniques complexes et limitées.
A la surface de ce virus, on trouve une protéine, dessinée en bleue ici, qui s’appelle hémagglutinine. Cette protéine « s’accroche » à une cellule cible. Et en s’accrochant elle change de forme, de structure. C’est ce changement de structure qui enclenche le signal de l’attaque, et permet à l’ADN du virus d’entrer dans la cellule cible, nos cellules en l’occurrence.
Donc, la forme 3D et les changements de forme 3D déterminent en grande partie l’activité que va avoir la protéine. Parce que cela modifie la proximité de différents groupes chimiques, et donc les effets physico-chimiques possibles.
Le logiciel Foldit, que vous voyez ici, a été conçu pour utiliser le pouvoir de résolution de joueurs humains afin de mieux prédire la structure 3D d’une protéine.
Lorsque l’on commence à jouer, on suit une série de tutoriaux qui apprennent à manipuler les protéines. Un score est visible en haut de l’écran. Le but est de bouger les différents éléments de la protéine entre eux afin de maximiser ce score.
En utilisant le pouvoir de résolution des humains, les concepteurs de Foldit espèrent mieux prédire la structure des protéines.
Et bingo !
En 2011, des joueurs ont permis de découvrir la structure 3D d’une enzyme, la protéase rétroviral du virus M-PMV (pour Mason-Pfizer monkey virus. Ils ont inauguré par la même occasion la première publication scientifique coécrite par des « gamers ».
Cette enzyme est particulièrement importante car elle est la cause du sida chez le singe, et sa structure est très proche de l’enzyme équivalente trouvée chez l’homme. Maintenant qu’ils connaissent mieux la structure, les chercheurs vont pouvoir mieux comprendre son fonctionnement et chercher des molécules ou protéines capables d’empêcher son activité infectieuse.
Et comment fait-on pour trouver des molécules empêchant une infection ?
Revenons à hémagglutinine que l’on trouve à la surface du virus de la grippe.
On voit représenter ici une partie de cette protéine, en bleu et beige.
La première étape du design de médicaments est de trouver un site actif, un endroit qui joue un rôle dans l’infection et dont on va vouloir neutraliser le fonctionnement. Une fois ce site trouvé, on va trouver une protéine capable de s' »accrocher » à ce site qui va donc empêcher l’infection.
Je passe sur l’étape de sélection d’éventuels candidates pour vous parler un peu plus de l’étape « optimisation ».
Lors de cette étape il s’agit de « jouer » avec les protéines. Un peu comme on joue à la poupée. On la déshabille, on met un pantalon à la place d’une robe et pouf, Barbie peut aller courir plus facilement. Avec les protéines c’est pareil, on peut s’amuser à changer les acides aminés et voir quels effets cela a sur leurs activités.
C’est intéressant si on veut optimiser la structure d’une molécule pour qu’elle interagisse plus et mieux avec une protéine. Et c’est particulièrement motivant lorsqu’on cherche à concevoir des médicaments comme ici.
Enfin, la structure de l’enzyme prédite par les joueurs de FoldIt était non résolue depuis plus de 10 ans ! Pourquoi est-ce si compliqué ?
En effet, nous connaissons les règles générales de repliement des protéines : les protéines cherchent à former une forme compacte, tout en enveloppant certains acides aminés – hydrophobes qui n’aiment pas l’eau – et en exposant d’autres hydrophiles qui aiment l’eau. D’autres interactions sont aussi à prendre en compte, comme les effets électrostatiques, la température ou encore la géométrie des liaisons chimiques.
En bref, la protéine va chercher à adopter une forme stable qui sera un compromis entre les différentes forces qui la tiraillent.
Mais étant donné la taille des protéines – les plus petites sont composées d’une centaine d’acides aminés, la plus grande en comporte environ 27,000- les possibilités de formes sont si nombreuses que même les ordinateurs ont du mal à toutes les explorer.
Et il faut déployer des méthodes complexes de calcul, d’optimisation, d’exploration de l’espace, d’approximation et de statistiques pour résoudre tout cela.
Et faire appel au formidable pouvoir de résolution des joueurs humains !
Pour conclure,
Puisqu’on est à Lyon, il convient de rappeler qu’il y a ici un pôle important de bioinformatique avec Sanofi mais aussi de nombreux laboratoires publics ainsi que des formations universitaires.
Aussi, le design moléculaire dont je vous ai parlé n’est que la première étape de la création d’un médicament. La conception et les tests prendront 10 ans. 10 ans de R&D avant de commercialiser un médicament. 10 ans pour passer de milliers de molécules à un médicament.
Si les mathématiques et l’informatique permettent d’accélérer la conception de médicament, on voit bien qu’ils ne peuvent pas tout et, pour se soigner, le meilleur atout reste, bien sûr, de trouver un bon médecin.